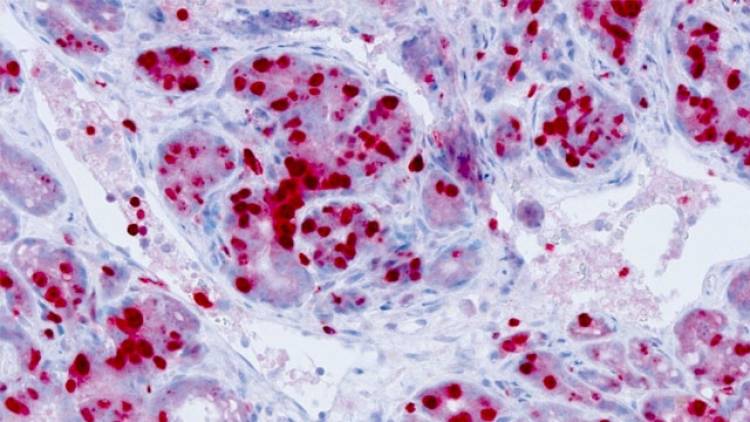
In ihrer Studie unter der Leitung von Dr. Florian Bassermann von der III. Medizinische Klinik am TUM-Klinikum rechts der Isar untersuchten die Wissenschaftler Mantelzelllymphome. Diese Form von Lymphdrüsenkrebs ist eine Untergruppe der Non-Hodgkin-Lymphome, bei denen Patienten trotz neuer Therapieverfahren schlechte Prognosen haben. „In vielen Lymphom-Zellen funktioniert der programmierte Zelltod nicht mehr und sie vermehren sich unkontrolliert. Um neue therapeutische Angriffspunkte zu finden, müssen wir dringend verstehen, was in diesen Zellen falsch läuft.“, erklärt Bassermann.
Die Wissenschaftler analysierten deshalb Zellproben aus menschlichen Mantelzelllymphomen, um dort in der DNA nach Fehlern zu suchen. Sie entdeckten eine Region, die in fast 30 Prozent der Patienten mutiert und damit defekt war. Die Wissenschaftler stellten fest, dass der Bereich notwendig war, um ein Enzym, die Ubiquitin-Ligase FBXO25, herzustellen. “Es ist bereits bekannt, dass Ubiquitin-Ligasen am Abbau von Proteinen in der Zelle beteiligt sind. Wir konnten jetzt zeigen, wie sie zur Entstehung von Lymphdrüsenkrebs beitragen können.“, so Bassermann.
Überlebensstrategie der Krebszellen
In zahlreichen Experimenten entschlüsselten die Wissenschaftler einen neuen Signalweg, der den programmierten Zelltod einleitet. Damit eine Zelle mit ihrer eigenen Zerstörung beginnt, muss zuerst ein Protein entsorgt werden, dessen Existenz in gesunden Zellen das Überleben sichert. Die Forscher entdeckten, dass die Ubiquitin-Ligase FBXO25 genau dieses Protein mit einem Signalmolekül markiert, damit es von der zellulären Müllabfuhr zerstört wird.
„Ein Fehler in der Ubiquitin-Ligase führt dazu, dass dieser Mechanismus nicht mehr funktioniert. Die betroffenen Tumorzellen zerstören sich nicht mehr selbst und wachsen unkontrolliert.“, beschreibt Bassermann die Folgen. Zudem konnten die Wissenschaftler zeigen, dass Zellen mit einer Mutation in FBXO25 signifikant schlechter auf Chemotherapeutika ansprachen – und damit die Tumore noch stabiler waren. In den untersuchten Krebszellen fanden die Forscher auch noch eine andere Mutation. Der Fehler lag in manchen Fällen auch beim „Überlebensprotein“ selbst, das aufgrund einer Mutation gegen den Abbau resistent war.
Ubiquitin-Ligasen als neues Ziel für Therapien
Nachdem die Wissenschaftler den neuen Signalweg aufgeklärt hatten, kam ihnen eine Idee für eine therapeutische Anwendung: Sie behandelten die Krebszellen so, dass sie wieder eine funktionsfähige Variante der Ubiquitin-Ligase bilden konnten. Die Krebszellen, die sich vorher durch den genetischen Defekt unkontrolliert geteilt hatten, zerstörten sich anschließend wieder selbst.
„Gerade unter dem Stichwort personalisierte Medizin, ist es sehr wichtig den genauen Fehler in einer Tumorzelle zu kennen, um Therapien besser auf die Tumorform anzugleichen. Unsere Ergebnisse zeigen, dass dieser neu entdeckte Signalweg für Mantelzelllymphome durchaus ein vielversprechender Therapieansatz sein könnte.“, fasst Bassermann zusammen.
Originalpublikation
Baumann U., Fernández-Sáiz V., Rudelius M., Lemeer S., Rad R., Knorn A.M., Slawska J., Engel K., Jeremias I., Li Z., Tomiatti V., Illert A.L., Targosz B.S., Braun M., Perner S., Leitges M., Klapper W., Dreyling M., Miething C., Lenz G., Rosenwald A., Peschel C., Keller U., Kuster B., and F. Bassermann, Disruption of the PRKCD-FBXO25-HAX-1 axis attenuates the apoptotic response and drives lymphomagenesis, Nature Medicine, 20, 1401-1409 (2014).
DOI: 10.1038/nm.3740
- Home

- News

- Forschung & Aufklärung

- Mutationen verhindern Zelltod – Neue Erkenntnis in der Krebsforschung
 thinkstockphotos.com
thinkstockphotos.com - 09. Januar 2015
- Pressemitteilung
Mutationen verhindern Zelltod – Neue Erkenntnis in der Krebsforschung
Der programmierte Zelltod ist ein Vorgang im Körper, der defekte oder potentiell gefährliche Zellen dazu bringt, sich selbst zu zerstören. Forscher der Technischen Universität München (TUM) haben einen bisher unbekannten Mechanismus entdeckt, der vom Körper zur Regulation des programmierten Zelltodes eingesetzt wird. Sie haben zudem feststellen können, dass Patienten mit Lymphdrüsenkrebs häufig Mutationen in diesem Signalweg tragen.